迦凡尼腐蝕又稱之為異種金屬腐蝕。兩種不同金屬在含有電解液的環境中接觸,因金屬間的電位差,而產生電耦合(electrically coupled),形成迦凡尼電池,化學性質活潑的金屬(陽極)發生氧化反應,惰性比較大的金屬(陰極)發生還原反應,進而引起金屬腐蝕的問題。
影響材料:
所有金屬,除了惰性較大的金屬。
重點摘要:
在API 571的定義,迦凡尼腐蝕發生的三個必要條件:
1. 必須有兩種(或至少兩個)不同的金屬,具有不同的電動勢。
2. 兩種金屬必須要發生電耦合,化學性質活潑的金屬(陽極)發生氧化反應,惰性比較大的金屬(陰極)發生還原反應。
3. 兩種金屬間存在電解液。
Fe à Fe2+ + 2e-
影響異種金屬腐蝕速率的因素,以下列出常見的因素:
1. 兩種金屬電位差越大,越容易腐蝕。
2. 如果陽極和陰極的接觸面積差越多,陽極小面積和陰極的大面積相接處,也越容易腐蝕,舉例來說,碳鋼螺絲和不鏽鋼法蘭相接,不鏽鋼的塔盤和碳鋼的支撐環相接。
3. 電解液的特性。
通常選用的保護方法有陰極防蝕,陰極防蝕有犧牲陽極(sacrificial anode)和外加電流(impressed current)兩種方法。
犧牲陽極的意思是原本的陽極是腐蝕速率較快的那一方,那現在外加一層比原本陽極更有活性的金屬上去,讓更有活性的金屬當陽極,而原本的陽極變成陰極,這樣就可以達到保護效果。
舉例來說,鋅粉底漆、熱浸鍍鋅的碳鋼就是一個最好的例子。碳鋼在大氣下會做氧化反應,失去電子,而加上鋅元素以後,由鋅做陽極,鋅會優先被反應,這樣就可以保護碳鋼了。
附帶一提,鋅不能鍍在不鏽鋼上,因為會有Liquid Metal Embrittlement。
當熱浸鍍鋅的碳鋼在65℃以上,添加空氣的水溶液(aerated water)環境,兩者金屬的電位差會反轉,碳鋼變成陽極,鋅變成陰極,這時候就要注意材料的選用。
除了異種金屬會產生電位差,外加電流、濃度差、溫度差也可以產生電位差。
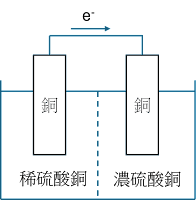
濃差電池: 當兩極上存有反應離子之濃度差異,它會使同一性質的兩根電極之間產生電位差,稱之為濃差電池。這在CUI、氯離子應力腐蝕裂紋、土壤腐蝕都是類似的機制原理。
溫差電池:在某些環境下處於不同的溫度,同一塊金屬也會產生電位差,溫度越高,還原電位越高,處在高溫的電極為陰極,處在低溫的電極為陽極。
外加電流是人為控制的電化反應,又稱之為電解電池,主要用在地下管線的陰極防蝕,但控制不好也會造成雜散電流,流經設計之電路以外之路徑的電流,或是大地中任何外來之電流稱為雜散電流,(引起雜散電流很多就不多介紹),雜散電流會引起地下管線的腐蝕。
文獻:
1.
API 571